Torrecillas, S.1*, Martin, M.2, Astorga, F.2, Román, L. 1 y Montero, D.1
1Grupo de Investigación en Acuicultura (GIA), IU-ECOAQUA, Universidad de Las Palmas de Gran Canaria, Crta. Taliarte s/n, 35214 Telde, Spain; 2 European Natural Additives (ENA), Julián Camarillo, 10, Oficina 317, 28037 Madrid, Spain.
*Presentadora (silvia.torrecillas@giaqua.org).
Introducción
Los estresores físicos asociados a la producción intensiva de peces (lesiones, manipulaciones y manejo) son bajos pero continuos. Estos procesos suelen derivar en una situación de estrés crónico que implica efectos supresores en el sistema inmunológico de los peces, en la resistencia a enfermedades y en el metabolismo energético, como resultado de la carga alostática impuesta al organismo (Tort, 2011). Estos efectos adversos se han asociado principalmente con un aumento en la secreción de cortisol por las células interrenales a través de la activación del eje HPI (Vijayan et al., 2005).
Los glucocorticoides tienen un potente efecto inmunosupresor en las células del sistema inmunológico de los vertebrados a través de: inducción de apoptosis, cambios en los patrones de diferenciación e inhibición de la liberación de citoquinas y migración de leucocitos (Baschant y Tuckermann, 2010; Tort, 2011). En este sentido, los compuestos naturales de origen vegetal pueden ser beneficiosos en la producción de peces como agentes preventivos y/o para aliviar las consecuencias del cultivo intensivo de peces. Los terpenoides son ácidos orgánicos de plantas con propiedades antioxidantes, ansiolíticas y sedantes (Nam et al., 2013) y los flavonoides son compuestos polifenólicos de plantas con fuertes actividades antioxidantes y antiinflamatorias (Tripoli et al., 2007), que, por ejemplo, pueden ayudar a los peces a reducir los efectos secundarios del estrés crónico al disminuir la concentración de glucocorticoides plasmáticos y/o recuperarse tras lesiones físicas derivadas de prácticas de manejo y manipulación.
Por tanto, el objetivo de este estudio fue evaluar el efecto de la suplementación dietética de una mezcla de terpenoides y flavonoides vegetales en la resistencia al estrés del lubina europea (Dicentrarchus labrax) a través de una serie de ensayos experimentales y comerciales.
Materiales y métodos
Para todo el estudio, se incluyó en las dietas comerciales de lubina europea una mezcla de flavonoides y terpenoides vegetales estandarizada mediante cromatografía líquida de alta resolución (HPLC) (ENARECOX2®) a 100 ppm. El estudio se llevó a cabo mediante una serie de experimentos, finalizando con un ensayo a escala comercial.
En el primer experimento, juveniles de lubina europea (peso medio de 30 g) se distribuyeron aleatoriamente en 12 tanques de fibra de vidrio cilindro cónicos de 500 L (densidad de siembra inicial de 3.1 kg·m-3; 6 tanques/dieta) y se alimentaron con dietas de control o ENARECOX2® (45% Proteína, 19% Lípidos, 10% Cenizas, 2% Fibra) durante 7 días. Posteriormente, los peces fueron sometidos a un estresor de confinamiento aumentando la densidad de siembra 10 veces (30 kg·m-3). Se extrajeron muestras de plasma a 0h, 2h (respuesta aguda) y 3 días (respuesta adaptativa) después del estrés para análisis de cortisol. La mortalidad se registró diariamente.
En el segundo experimento, se utilizaron dos jaulas (1 control y 1 ENARECOX2®) de lubina europea adulta (peso medio de 500 g; densidad de siembra de 10 kg·m-3) que fueron alimentadas con dietas de control o ENARECOX2® (43% Proteína, 18% Lípidos, 9% Cenizas, 2% Fibra) durante 7 días antes del cambio rutinario de redes. Se recolectaron muestras de escamas de peces muertos atrapados en las redes para medir el cortisol crónico. Un tercer experimento, basado en los resultados obtenidos en los Experimentos I y II, se diseñó a escala comercial. Para ello, se utilizaron 3 jaulas (1 control y 2 ENARECOX2®) de lubina europea adulta (peso medio de 500 g) que fueron alimentadas con dietas de control o ENARECOX2® (43% Proteína, 18% Lípidos, 9% Cenizas, 2% Fibra) durante 15 días antes de la cosecha. Se recolectaron muestras de plasma (1h después de comenzar la cosecha) y escamas para analizar los niveles de cortisol plasmático y crónico.
Resultados
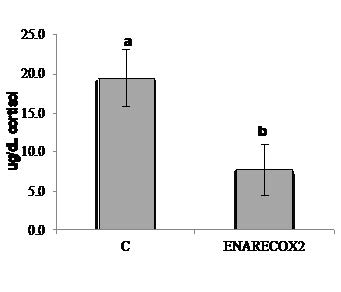
En el experimento I, los peces alimentados con la dieta ENARECOX2® presentaron niveles de cortisol basal (0h) más bajos (P<0.05) que los peces alimentados con la dieta de control después de 7 días de alimentación. Sin embargo, no se encontraron diferencias (P>0.05) en los niveles de cortisol plasmático a lo largo del panel de estrés entre los peces alimentados con la dieta de control y la de ENARECOX2®, presentando todos los peces evaluados el patrón típico de respuesta al estrés agudo por confinamiento (2h) y recuperando los niveles basales después de 3 días del desafío. La lubina europea alimentada con la dieta ENARECOX2® presentó un porcentaje de mortalidad acumulada reducido (P<0.05) en comparación con los peces alimentados con la dieta de control al final del desafío por estrés. En el experimento II, las escamas de los peces alimentados con la dieta ENARECOX2® presentaron una menor acumulación de cortisol que los peces alimentados con la dieta de control (7.70±4.40 y 1.00±0.38 μg/kg, respectivamente). En el experimento III, no se encontraron diferencias en el cortisol plasmático (P>0.05) entre los lubinas europeas adultas alimentadas con la dieta de control y la de ENARECOX2®, presentando todos los peces evaluados un patrón similar de respuesta al estrés por manipulación (cosecha comercial) en consonancia con los resultados encontrados en el Experimento I. Además, las mediciones de cortisol crónico en escamas también se correlacionaron con los resultados obtenidos en el Experimento II.

Referencias
• Tort, Ll., 2011. Estrés y modulación inmune en peces. Inmunología Comparativa y del Desarrollo, 35: 1366-75.
• Vijayan, M.M., Prunet, P., Boone, A.N. 2005. Impacto xenobiótico de la señalización de corticosteroides. 6:365-394. En: Bioquímica y Biología Molecular de Peces. Toxicología Ambiental. Moon, T.W., Mommsen, T.P. (Editores). Elsevier B.V.
• Baschant, U., Tuckermann, J., 2010. El papel del receptor de glucocorticoides en la inflamación y la inmunidad. Revista de Bioquímica de Esteroides y Biología Molecular, 120:69-75.
• Nam, S.M., Choi, J.H., Yoo, D.Y., Kim, W., Young, H., et al. 2013. El extracto de Valeriana officinalis y su componente principal, el ácido valereno, mejoran las reducciones inducidas por D-galactosa en la memoria, la proliferación celular y la diferenciación de neuroblastos al reducir los niveles de corticosterona y la peroxidación lipídica. Gerontología Experimental, 48:1369-77.
• Tripoli, E., Guardia, M.L., Giammanco, S., Majo, D.D., Giammanco M. 2007. Flavonoides cítricos: estructura molecular, actividad biológica y propiedades nutricionales: una revisión. Química de Alimentos, 104:466-79.





